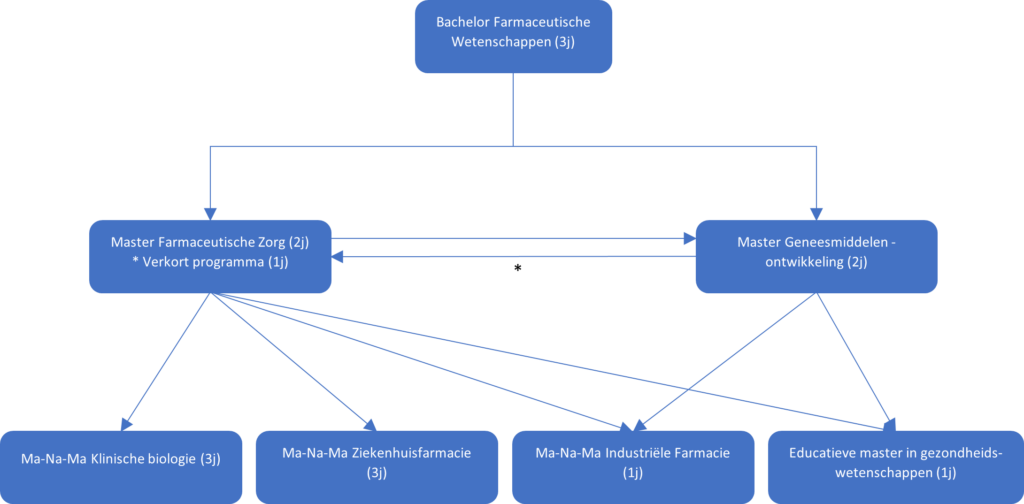
Eens je een master in de Farmaceutische Zorg of Geneesmiddelenontwikkeling op zak hebt, zijn de mogelijkheden om ergens aan de slag te gaan breed. Je had misschien altijd het idee om in een apotheek te werken, maar dat is zeker niet je enige optie. Afhankelijk van je interesses, kunnen verschillende trajecten afgelegd worden (zie Figuur 1), welke kunnen leiden tot verschillende jobopportuniteiten.
In het geval dat je voor een carrière buiten de (ziekenhuis)apotheek wilt gaan, kan het moeilijk zijn om te weten waar te beginnen. Tijdens de master geneesmiddelenontwikkeling krijg je al een globaal beeld over de weg dat een geneesmiddel aflegt en welke organisaties hierbij betrokken zijn oa. een (bio)farmaceutisch/technologisch bedrijf, analytisch laboratorium, clinical investigational site, … maar dit is zeer breed en blijft allemaal vrij oppervlakkig. Er wordt tijdens de studiejaren dan ook vaak gezegd: “Je kan overal terechtkomen, kies maar wat je wilt doen”, maar toch blijft dit niet veelzeggend.
Als net afgestudeerde student farmaceutische wetenschappen weet je soms niet wat je wilt/waar je moet solliciteren. Functies zoals QA Officer, MSL, CRA, etc kunnen onbekend in de oren klinken, laat staan dat je weet wat deze functies precies inhouden.
Vandaar, hieronder enkele voorbeelden van jobs die zich aanbieden, na het afstuderen binnen één van de master richtingen vermeld in Figuur 1.
Qualified Person (QP)
Als QP ben je eindverantwoordelijke voor de batch certificatie en -vrijgave (release). De certificatie en vrijgave dienen in overeenstemming te verlopen met wat werd vastgelegd in Annex 13 en Annex 16 van de Eudralex Vol.4.[1]
Je zal een release dossier voorbereiden waarin alle relevante documenten, met informatie over de vrij te geven batch, gecapteerd worden. Op deze documenten gebeuren twee types van review: 1) check tov Good Manufacturing Practices (GMP) compliance & 2) check tov Regulatory Compliance.
Afhankelijk van jouw review zal een geneesmiddel dus vrijgegeven of afgekeurd worden. In het laatste geval betekent dit dus dat het geneesmiddel niet tot bij de apotheker/clinical investigational site zal geraken, en op zijn beurt dus niet tot bij de patiënt.
Enkele documenten die deel kunnen uitmaken van het release dossier zijn: Certificate of Analysis (CoA), Label pictures, Release statements, Deviation reports, Change Control reports, SAP traceability data, IMPD, SmPC,…
Als QP zal je kritisch moeten zijn en kennis moeten hebben over de gehele supply chain van de vrij te geven batch, ook zal je de de farmaceutische wetgeving goed moeten opvolgen.
- Voor meer informatie kan je altijd bijFarma Consulting & Partners terecht.
- Diploma Ma-Na-Ma Industriële Farmacie is een minimum vereiste.
Quality Assurance Officer (QA Officer)
Als QA Officer ben je verantwoordelijk voor het creëren, onderhouden en optimaliseren van een kwaliteitsmanagementsysteem (QMS). Dit om te verzekeren dat er kwaliteit en compliance is met de Good Manufacturing Practices (GMP), andere regelgeving en interne procedures. Je zal dit vooral doen door het schrijven/updaten van interne procedures (SOP), uitvoeren van interne audits, hosten van externe/gezondheidsauthoriteiten audits, trainingen te geven (oa. jaarlijkse GMP training), supplier/vendor kwalificatie, behandelen van non-conformiteiten (deviaties, OOS, complaints) en implementeren van Change Management & CAPA’s gebruik makende van een risk-based-approach.
Daarnaast kan je als QA Officer ook fungeren als de rechterhand van de QP, dit door ondersteuning te bieden bij het voorbereiden van een release dossier.
- Voor meer informatie kan je altijd bijFarma Consulting & Partners terecht.
Quality Control Analyst (QC Analyst)
Als QC Analyst ben je voornamelijk te vinden in het labo. Je zal ervaring opdoen in het uitvoeren van verschillende analytische technieken ((U)HPLC, Flow Cytometry, GC, qPCR, CE, DSC, IR spectroscopy, Raman, XRD, KF titratie,…), het maken van berekeningen, het interpreteren en rapporteren van de resultaten,… Ook het reviewen van andermans analyses, trainingen geven aan nieuwkomers en mee nadenken over het optimaliseren van bepaalde analysemethodes kan deel zijn van het takenpakket.
De kans is groot dat je in een toffe labo-sfeer terechtkomt, waar iedereen klaarstaat om elkaar te helpen.
Regulatory Affairs Officer (RA Officer)
Als RA officer sta je in voor het Life Cycle Management van een geneesmiddel. Alles begint bij het verkrijgen van een MA (marketing authorization), wat iets heel dynamisch is. Er zijn continu wijzigingen die kunnen plaatsvinden in dossiers omwille van regulatoire vereisten of nieuwe wetenschappelijke informatie.
Aan de hand van “variaties” zal je deze wijzigingen maken in de dossiers oa. in de productinformatie (bijsluiter, wetenschappelijk bijsluiter voor HCP en verpakkingsteksten), na evaluatie en goedkeuring van de gezondheidsautoriteiten.
Je zal dus veel in contact staan met de gezondheidsauthoriteiten, maar ook met interne collega’s zoals market access, QA, …
RA zorgt er dus voor dat de JUISTE informatie tot bij de patiënt komt.
“There will come a time when you believe everything is finished. That will be the beginning”
- Voor meer informatie kan je altijd bij Anke Nijst terecht.
Pharmacovigilance Officer (PV Officer)
Deze functie bestaat voornamelijk uit het verzamelen en documenteren van PV informatie (e.g. bijwerkingen die iemand ondervindt na het innemen van een geneesmiddel), en dit in lijn met de Europese wetgeving voor geneesmiddelenbewaking.
Een farmaceutisch bedrijf kan op verschillende manieren geïnformeerd worden over bijwerkingen; een spontane melding van een patiënt, tijdens een bezoek van een MSL of sales representative aan een arts, via patiënten die opgevolgd worden in een patiënt support programma of tijdens het screenen van wetenschappelijke artikels.
Eens de PV informatie het farmaceutisch bedrijf bereikt, maak je als PV officer binnen een bepaalde termijn een Individual Case Safety Report (ICSR) aan. Dit report zal worden doorgestuurd naar de gezondheidsautoriteiten.
Als PV officer ben je ook verantwoordelijk voor het trainen van collega’s in andere departementen over hun rapporteringsverantwoordelijkheid.
- Voor meer informatie kan je altijd bij Julie Van Dyck terecht.
Clinical Research Associate (CRA)
Als CRA ben je verantwoordelijk voor het opstarten, begeleiden en controleren van klinische studies in ziekenhuizen. Je leidt artsen en verpleegkundigen op, begeleidt hen waar nodig doorheen de klinische studie en controleert of ze de protocol specifieke procedures volgen.
Het is een job waarbij je veel op de baan bent, waarbij je veel sociale interactie hebt en waarbij je je medische kennis kan gebruiken door oa. patientendossiers te interpreteren, consultaties te volgen en met artsen in discussie te gaan.
- Voor meer informatie kan je altijd bij Birte De Jongh terecht.
Brand Manager
Als Brand Manager zorg je dat er materiaal gemaakt wordt (met feedback van de artsen) voor de sales representatives. Je krijgt elk jaar een bepaald budget voor materialen, het organiseren van webinars, bepaalde commerciële campagnes en value based healthcare projecten. Het is belangrijk dat je als Brand Manager de strategie en visie van jouw product bepaalt/volgt en zorgt dat de verschillende activiteiten hiermee in lijn liggen. Ieder kwartaal dient er ook een performance review plaats te vinden, om aan te tonen hoe het product geëvolueerd is afgelopen kwartaal. Daarnaast wordt er één keer per jaar een brand plan opgesteld, om uit te leggen wat de strategie en het doel is voor komend jaar.
- Voor meer informatie kan je altijd bij Isabelle Schollaert terecht.
- Diploma General Management aan Vlerick Business School kan een meerwaarde zijn.
Health Economics and Market Access Specialist (HEMA Specialist) – binnen de medische hulpmiddelen industrie
Als HEMA verantwoordelijke probeer je de patiëntentoegang tot innovatieve medische hulpmiddelen in België te verhogen, dit door oa vergoedingen voor deze hulpmiddelen te verkrijgen. Hiervoor is het belangrijk om de toegevoegde klinische en economische waarden voor de samenleving, het ziekenhuis, de arts en vooral de patiënt en naasten aan te tonen, alsook om de juiste interne en externe stakeholders te betrekken.
Naast het verkrijgen van vergoedingen analyseer je ook de transformaties in het gezondheidszorgsysteem (vb. de verandering van de ziekenhuisfinanciering van “fee for service” naar “DRG”[2]): wat deze betekenen voor de toegang tot medische hulpmiddelen en hoe we dezen kunnen beïnvloeden. Hiervoor wordt vaak samengewerkt met de gehele medische hulpmiddelen industrie, via de handelsfederatie (beMedTech).
- Voor meer informatie kan je altijd bij Laura Vertommen terecht.
En nog zoveel meer
Natuurlijk is dit maar een beperkte lijst. Er is nog niet gesproken over Medical Science Liaison (MSL), Sales Representative, Scientist, Group/Team Leader, Medical Affairs, etc… Laat staan over jobs buiten de (bio)farmaceutische industrie, zoals een doctoraat of beleidsmatige functies binnen het RIZIV, FAGG,…
Talloze jobopportuniteiten doen zich voor, dus ga zeker in dialoog met anderen! Bij Farma Consulting & Partners komen we in contact met verschillende bedrijven & functies, dus aarzel niet om contact op te nemen indien je graag wat meer info wenst!
[1] Eudralex Vol.4 bevat richtlijnen voor de interpretatie van de “richtlijnen voor goede praktijken bij het vervaardigen van geneesmiddelen” (Good Manufacturing Practices) voor menselijk en diergeneeskundig gebruik
[2] Het ziekenhuis krijgt niet meer betaald per activiteit, maar per opgenomen patient met een bepaalde diagnose.
Geschreven door Lien Secretin
Met behulp van Anke Nijst, Birte De Jongh, Isabelle Schollaert, Julie Van Dyck en Laura Vertommen.