Enkele maanden geleden schreef onze consultant Clara een blog over serialisatie en de strijd tegen vervalsing van geneesmiddelen. Ze lichtte het principe serialisatie toe voor geneesmiddelen verdeeld op de Europese markt en haalde het voorbeeld Ozempic aan. In huidige blog zal onze consultant Esther inzoomen op de serialisatievereisten aan de overkant van de Atlantische oceaan, meer bepaald in de Verenigde Staten.
Wetgeving
De United States (US) Federal Drug Supply Chain Security Act (DSCSA) is een federale wetgeving die in 2013 werd uitgegeven door de Food and Drug Administration (FDA), met als doel de veiligheid en traceerbaarheid van geneesmiddelen in de Amerikaanse supply chain te verbeteren. Op deze manier kan de Amerikaanse overheid zijn burgers beschermen tegen zowel namaakgeneesmiddelen, gestolen geneesmiddelen als andere potentieel gevaarlijke geneesmiddelen die mogelijks circuleren in de supply chain.
De FDA gaf farmaproducenten, -distributeurs, -herverpakkers en verstrekkers (apotheken en ziekenhuizen) een periode van 10 jaar om via een progressieve gefaseerde approach te voldoen aan de DSCSA vereisten, met als einddatum 27 november 2023. In augustus vorige jaar werd echter een uitstel van één jaar toegekend aan de farmaceutische industrie, waardoor de uiterste implementatie deadline nu op 27 november 2024 ligt. Deze stabilisatieperiode van één jaar moet tegemoetkomen aan de extra tijd die alle partijen nodig hebben om hun processen en systemen te verfijnen en stabiliseren.
Vereisten
De DSCSA vereisten voor de farmaceutische industrie kunnen onderverdeeld worden in vier pijlers:
1. Product identificatie
Deze pijler omvat de principes van serialisatie en aggregatie.
Serialisatie:
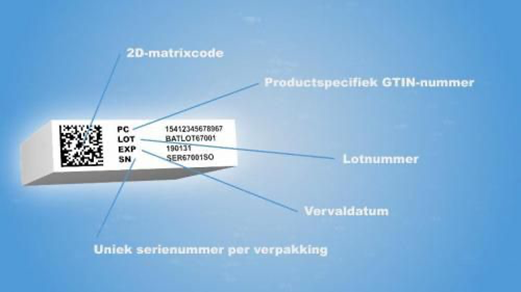
= De unieke identificatie van individuele units (geneesmiddeldoosjes) door middel van toegewezen serienummers. Deze serienummers worden op het doosje geprint samen met productcode, lotnummer en vervaldatum, alsook de 2D matrix welke deze info bevat.
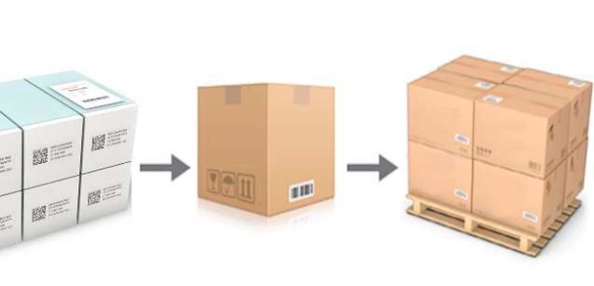
Aggregatie
= Met behulp van serienummers een individuele unit (geneesmiddeldoosje) linken aan de verpakkingsniveaus verder in de supply chain (cases en palletten). Op deze manier worden hiërarchische relaties opgebouwd en is de exacte inhoud van een case of pallet gekend.
Om te voldoen aan de DSCSA vereisten is minimaal een ‘unit to case’ aggregatie nodig. Echter kiezen de meeste farmaproducenten ervoor om ook een ‘case to pallet’ aggregatie te implementeren zodat de processen verder in de supply chain efficiënter kunnen verlopen. Op deze manier kan namelijk bij ontvangst van een pallet het palletlabel gescand worden en hoeft de pallet niet geopend te worden om de labels op de individuele units of cases te scannen.
2. Product verificatie
Product verificatie is gebaseerd op het principe van verticale rapportering. De DSCSA schrijft voor dat een teruggestuurd intact geneesmiddeldoosje enkel opnieuw verkocht mag worden indien de authenticiteit vooraf geverifieerd werd. Op welke manier dit moet gebeuren wordt niet gespecifieerd. Het is een beslissing van de farmaceutische industrie dat elke farmaproducent de product specifieke data (serienummer, GTIN, lotnummer, expiry date) van elk geneesmiddeldoosje oplaadt in zijn ‘Verification Router Service’ (VRS). De distributeurs en verstrekkers verder in de supply chain kunnen, indien ze geabonneerd zijn op de VRS, via deze service verifiëren of de data op het geneesmiddeldoosje overeenkomt met de data opgeladen in de VRS. Indien een distributeur of verstrekker niet geabonneerd is op de VRS kan deze de producent rechtstreeks contacteren om de data op het doosje te controleren.
3. Tracing
Tracing is gebaseerd op het principe van ‘transfer of ownership’ en horizontale rapportering. De specifieke data van elke individuele geneesmiddeldoosje wordt overgedragen van de ene stap in de supply chain naar de volgende, van producent tot en met verstrekker. Ook de verzend- en transportinformatie wordt hierbij gedeeld. Op deze manier kan een volledig beeld geschetst worden van het traject dat het geneesmiddeldoosje afgelegd heeft in de supply chain. Wanneer er een vermoeden is van een verdacht geneesmiddeldoosje kan met deze informatie onderzocht worden waar het verdacht geneesmiddeldoosje in de supply chain werd binnengebracht. Belangrijk om hierbij te vermelden is dat dit volledige pakket aan informatie enkel beschikbaar gesteld moet worden indien onderzoek in kader van een verdachte geneesmiddelverpakking nodig is na een klacht van één van de ‘authorized trade partners’, de FDA of de ‘State Board of Pharmacy’, of bij procescontroles door de autoriteiten.
4. Authorized Trade Partner
Een producent mag enkel geneesmiddelen verkopen aan distributeurs en verstrekkers met een geldige vergunning. Op zijn beurt mogen distributeurs en verstrekkers enkel geneesmiddelen kopen van respectievelijk producenten en distributeurs met een geldige vergunning. Het is aan de producenten, distributeurs en verstrekkers zelf om hun partners te controleren op het hebben van die vergunning.
Conclusie
Net zoals bij de uitgave van de Europese serialisatievereisten bracht de uitgave van DSCSA heel wat werk met zich mee voor farmaceutische bedrijven. Het primaire doel van beide wetgevingen is hetzelfde, namelijk het waarborgen van de integriteit van de geneesmiddelen supply chain, het circuleren van vervalste geneesmiddelen voorkomen en de gezondheid en veiligheid van patiënten verbeteren. De manier waarop de European Medicines Agency en de FDA dit vertaald willen zien heeft gelijkenissen maar heeft ook heel wat verschillen, waardoor dit ook voor farmaceutische bedrijven die reeds conform de Europese serialisatierichtlijnen produceren alweer een stevige opdracht was.